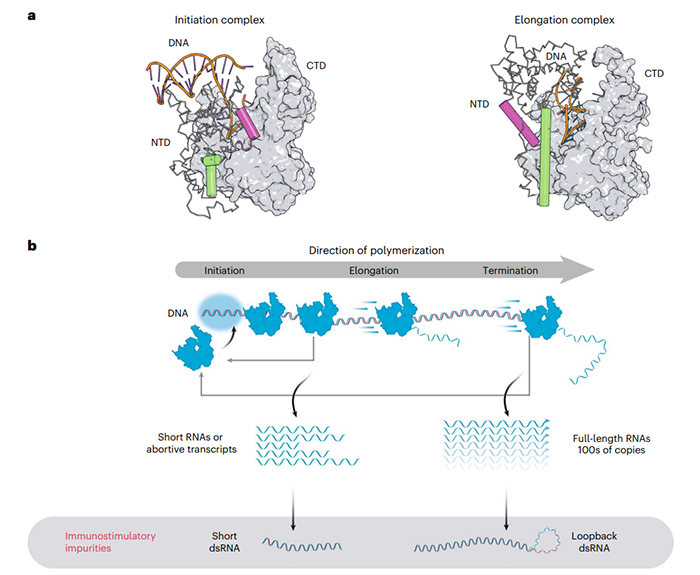
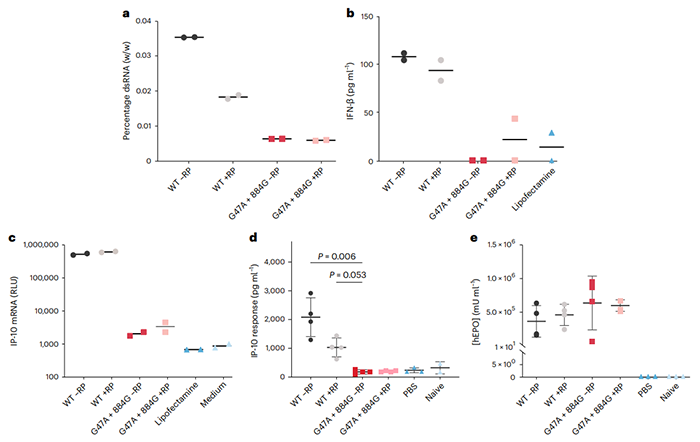
mRNA疗法是一种新兴的药物,与大分子生物制剂和小分子药物相比有一些优势。从制造业的角度来看,mRNA疗法的一个关键的优势是可以使用单一的标准化生产工艺,适用于一系列靶点。为了确保重复或长期给药的治疗应用过程中mRNA的高纯度,需要几个高成本和耗时的纯化步骤。这些额外的操作步骤常常导致RNA降解增加、质量下降和/或产量下降,因此,我们需要一个更有效的mRNA合成过程,以减少下游纯化步骤的负担。2022年11月10日,Moderna公司的研究人员在 Nature Biotechnology 期刊发表了 题为:An engineered T7 RNA polymerase that produces mRNA free of immunostimulatory byproducts 的研究论文。研究团队通过理性设计开发了一种T7 RNA聚合酶的双突变体,与野生型T7 RNA聚合酶相比,突变体可以简化体外转录(IVT)的mRNA生产过程,在不降低产量的情况下,提高mRNA产物纯度,显著减少免疫刺激性副产物双链RNA(dsRNA)的产生,还具有更快的生产时间。这一发现为简化治疗性mRNA生产过程的开发、提高成本效益、生产具有临床或商业用途的基于mRNA的产品打开了大门。体外转录(IVT)是一种用于合成mRNA产物的酶促过程。在IVT过程中,RNA聚合酶(RNAP)负责从DNA模板转录RNA。尽管IVT在研究实验室中是一个公认的过程,但工业规模生产的优化只是最近才开始。体外转录(IVT)最常用的聚合酶是T7 RNA聚合酶,分子量约99kDa。由于其高产率和转录本的高保真度,很适合体外RNA的生产,因此在科研和商业化开发中得到了普遍应用。然而,T7RNA聚合酶也会产生多种副产物,包括从模板转录产生的免疫刺激性副产物双链RNA(dsRNAs),这些可能会影响药效和安全性,特别是在治疗应用中。在体外转录(IVT)过程中双链RNA(dsRNAs)和其他副产物的产生受催化循环中T7 RNA聚合酶构象的影响。T7 RNA聚合酶介导的转录包括三个不同的阶段:起始、延伸和终止。在启示过程中,T7 RNA聚合酶的N端结构域(NTD)与启动子序列结合,形成起始复合体(IC)。这种起始复合物是不稳定的,会产生短RNA转录本(长度为2-10个核苷酸)。转录本长度大于~10个核苷酸时,NTD中的启动子结合残基重新排列,释放DNA启动子区域,形成一个稳定的、过程性的酶延伸复合体(EC)。终止则发生在对特定信号序列的响应或到达线性化DNA模板末端时,这个过程被称为“失控转录”,通常会产生全长RNA,但有时会在其3'端产生非模板的附加物。此外,T7 RNA聚合酶还具有以RNA为模板的转录能力,从而形成双链RNA(dsRNAs)产物和回环dsRNA产物。这种3'端的异质性和回环dsRNA形成的背后的确切机制尚不清楚。因此,设计合理的方法来防止这两种行为都具有挑战性。双链RNA(dsRNAs)分子是先天免疫反应激活因子,能够被RIG-I、MDA5和LGP2等识别,从而触发机体的天然免疫反应。因此,这些dsRNA分子会影响mRNA产物的效力和安全性,需要额外的纯化步骤从最终的mRNA产物中去除dsRNA。在生产过程中通常使用两种方法来减少mRNA产物中的dsRNA,一种是用色谱法纯化mRNA产物,例如反相高效液相色谱法(RP-HPLC)或基于纤维素的dsRNA分离;二是优化体外转录(IVT)条件以减少副产物的形成。修改体外转录(IVT)条件可以有效地减少dsRNA负担,但还不足以消除通过反相高效液相色谱法(RP-HPLC)对mRNA产物进行下游纯化的需要,而RP-HPLC一个昂贵且耗时的步骤。在这项研究中,研究团队报道了一种双突变T7 RNA聚合酶(G47A+884G),它可以显著减少体外转录(IVT)中的dsRNA副产物,同时保持mRNA的产量和纯度,从而减少下游纯化过程中控制转录相关dsRNA副产物的负担。总的来说,这项研究表明,通过修饰T7 RNA聚合酶可以减少免疫刺激性副产物的形成。这一发现为简化治疗性mRNA生产过程的开发、提高成本效益、生产具有临床或商业用途的基于mRNA的产品打开了大门。该论文的通讯作者为Moderna公司的Amy Rabideau,第一作者为Athanasios Dousis(目前已加入Tessera)、Kanchana Ravichandran。https://www.nature.com/articles/s41587-022-01525-6